2001年,加州理工大学的Raymond J.Deshaies教授和耶鲁大学的Craig M.Crews教授首次提出PROTAC的概念。报道了基于多肽的双功能小分子诱导MetAP-2(甲硫氨酸氨基肽酶-2)蛋白降解,但由于多肽化合物分子量大,难以进入细胞,导致难以在细胞内实现靶蛋白的有效降解,因此Crews等人的研究一直没有突破性的进展。
直到2008年,Crews团队基于E3泛素连接酶MDM2设计出了可用于降解雄激素受体(AR)的第二代PROTACs。
Crews教授2013年成立了全球首家以PROTAC技术进行药物研发的公司Arvinas。该公司的在研药物ARV-110和ARV-471已经进入临床二期研究阶段。
2015年Crews团队基于新型E3泛素连接酶VHL和CRBN配体设计出使多种蛋白的水平降低超过90%的新一代PROTACs。
同年,诺华的研发负责人James Bradner在《Science》上发表新一代基于沙利度胺类似物的PROTAC分子,从而引爆了整个领域。
随后,BRD4、RIPK2、ERRα、BRD9、TBK1、Sirt2、CDK9、p38α、Pirin、c-Met、EGFR、FAK、FLT3等蛋白先后被报道可以利用PROTAC技术将其降解。PROTAC技术被运用于各种疾病的临床研究越来越广泛(如:肿瘤与神经退行性疾病等)。
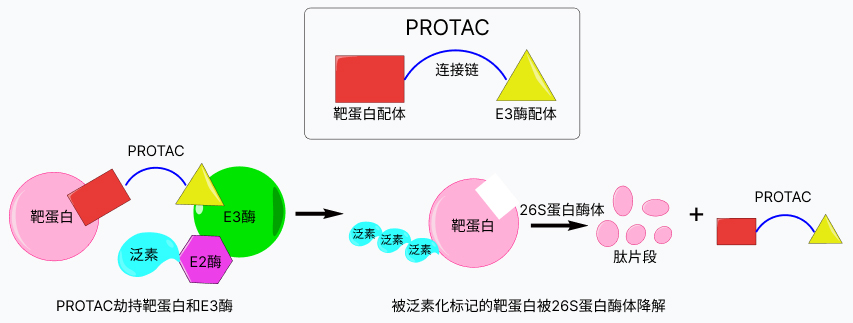
PROTAC通过劫持靶蛋白和E3酶形成三元复合物,诱导蛋白-蛋白间的交互作用,使靶蛋白泛素化,从而被体内的26S蛋白酶体所识别,降解为碎裂的肽片段。在该过程中,PROTAC不会被降解,还可以继续参与该过程。

PROTAC技术,之所以被称为“破解不可成药靶点神器”,正因为它能攻克传统药物难以成药的靶点。
PROTAC能将靶点从“无成药性”变成“有成药性”。人体细胞中约有80%的蛋白缺乏酶活性或者表面缺乏成药位点的蛋白,而PROTAC可以捕捉到这些难以成药的蛋白,并进行降解。
例如,2020年4月10日,至今30多年无靶向KRAS的药物获批上市的、被药界称为“不可成药”的靶点KRAS,被Crews团队攻克了∶开发了降解KRASG12C突变体的PROTAC分子LC-2,能快速降解不同纯合体和杂合体肿瘤细胞中的KRASG12C,是报道的首个可以降解内源性KRASG12C的化合物。
2、耐药性由于点突变的存在,一些激酶的小分子抑制剂经常产生耐药性,失去对靶蛋白的抑制作用,而PROTAC技术可以直接将靶蛋白降解,可以避免这一问题。
例如,2019年3月,清华大学药学院饶燏教授及团队在体内试验中证明,利用PROTAC技术降解多种突变型BTK蛋白,能够有效抑制治疗慢性淋巴细胞白血病等B细胞癌的全球知名BTK抑制剂依鲁替尼耐药性。
3、多种给药途径传统的小分子药物主要以口服为主,但PROTAC技术可以满足不同患者的需求,可口服给药、也可注射,避免了因长期静脉注射带来的心血管负担。
4、用量小,毒性和药物抗性低这个过程类似于催化反应,药物又可以重复利用,抑制目标蛋白,并不需要等摩尔量的药物,使用催化剂量即可达到效果,无须足够大的剂量使靶点饱和,所以对PROTAC的活性要求也许不需很高,可选择性高,而且无须足够长的半衰期即可持续抑制。
此外,PROTAC小分子还有清除蛋白堆积,以及可以在蛋白表达、修饰后选择性降解同一基因表达的不同蛋白等优势。

目前,全球已有不少制药公司布局PROTAC技术研发。例如,具备先发优势的Arvinas、C4 Therapeutics、Kymera Therapeutics等,后来跟进布局的公司有默克、基因泰克、辉瑞、诺华、勃林格殷格翰等跨国制药巨头。国内如恒瑞医药、凌科药业、分迪科技、苏州开拓药业等都有涉猎。其中,研发成果最突出的,当属PROTAC技术主要发明人Crews教授创立的Arvinas公司。
连接链的结构和长度对PROTAC的生物活性起着至关重要的作用,因为连接链可以影响总体PROTAC构象和结合方向以及三元复合物的形成。因此,连接链的作用远不止简单地连接两个分子实体。它直接影响PROTAC的活性、选择性和理化性质。

PHCTAC通过劫持靶蛋白和F3胞形成三元复合物,诱导蛋户-蛋白间的交互作用,使靶蛋白泛素化,从而被体内的2S蛋白酶体所识别,隐解为碎裂的肽片段。在该过程中,PROTAC不会被降解,还可以继续参与该过程。
“事件驱动(event driven)”﹔而非“占位驱动(occupancy driven)”无论是小分子抑制剂;还是大分子抗体,都需要持绿占据靶蛋白的活性位点以阻断功能,属于“占位驱动”。这就需要药物满足∶足够大的剂量,使靶点饱和;足够长的半衰期,能持续抑制;足够高的亲和力:抢得过原装〔配体/受体〉。因此,小分子药物常常面临渚如:剂量大、副作用大;亲和力太高,容易导致脱靶毒性、靶点突变/过表达,出现耐药性,等问题。
除了作用靶点广以外,protac的价值远不止于此。他还有着诸多优势 1、成药性高PROTAC技术,之所以被称为“破解不可成药靶点神器”﹔正因为它能攻克传统药物难以成药的靶点。
PROTAC能将靶点从“无成药性”变成“有成药性”。人体细胞中约有80%的蛋白缺乏酶活性或者表面缺乏成药位点的蛋白,而PROTAC可以捕捉到这些难以成药的蛋白,并进行降解。
例如,2020年4月10日,至今30多年无靶向KRAS的药物获批上市的、被药界称为“不可成药”的靶点KRAS,被Crews团队攻克了∶开发了降解KRASG12C突变体的PROTAC分子LC-2,能快速降解不同纯合体和杂合体肿瘤细胞中的KRASG12C,是报道的首个可以降解内源性KRASG12C的化合物。
2、耐药性由于点突变的存在,一些激酶的小分子抑制剂经常产生耐药性,失去对靶蛋白的抑制作用,而PROTAC技术可以直接将靶蛋白降解,可以避免这一问题。
例如,2019年3月,清华大学药学院饶懦教授及团队在体内试验中证明,利用PROTAC技术降解多种突变型BTK蛋白,能够有效抑制治疗慢性淋巴细胞白血病等B细胞癌的全球知名BTK抑制剂依鲁替尼耐药性。
3、多种给药途径传统的小分子药物主要以口服为主,但PROTAC技术可以满足不同患者的需求,可口服给药、也可注射,避免了因长期静脉注射带来的心血管负担。
4、用量小,毒性和药物抗性低这个过程类似于催化反应,药物又可以重复利用,抑制目标蛋白,并不需要等摩尔量的药物,使用催化剂量即可达到效果,无须足够大的剂量使靶点饱和,所以对PROTAC的活性要求也许不需很高,可选择性高,而且无须足够长的半衰期即可持续抑制。
此外,PROTAC小分子还有清除蛋白堆积,以及可以在蛋白表达、修饰后选择性降解同一基因表达的不同蛋白等优势。
目前,全球已有不少制药公司布局protac技术研发。
例如,具备先发优势的Arvinas.C4 Therapeutics.Kymera Therapeutics等,后来跟进布局的公司有默克、基因泰克、辉瑞、诺华、勃林格殷格翰等跨国制药巨头。国内如恒瑞医药、凌科药业、分迪科技、苏州开拓药业等都有涉猎。其中,研发成果最突出的,当属PROTAC技术主要发明人Crews教授创立的Arvinas公司。
连接链的结构和长度对PROTAC的生物活性起着至关重要的作用,因为连接链可以影响总体PROTAC构象和结合方向以及三元复合物的形成。因此,连接链的作用远不止简单地连接两个分子实体。它直接影响PROTAC的活性、选择性和理化性质。